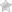Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
- Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
- Алифатические аминокислоты
- Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
- Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
- Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
- Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
- Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
- Серусодержащие кислоты: цистеин, метионин.
- Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
- Гетероциклические аминокислоты: триптофан, гистидин, пролин.
- Иминокислоты: пролин.
- Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
- Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
- Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
- Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
- 1. Неполярные (гидрофобные)
- К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
- — алифатические: аланин, валин, лейцин, изолейцин
- — ароматические: фенилаланин, триптофан.
- — серусодержащие: метионин
- — иминокислота: пролин.
- 2. Полярные незаряженные
- Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
- К ним относятся аминокислоты, содержащие:
- — полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
- — HS-группу: цистеин
- — амидную группу: глутамин, аспарагин
- — и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
- 3. Заряженные отрицательно при рН-7 (кислые)
- Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
- Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
- 4. Заряженные положительно при рН-7 (основные)
- К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
- В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
- В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
- Основные
- Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
- Кислые
- Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
- Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:
VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
- Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
- Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
- При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
- Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
- При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте.
Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
- В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
- Продукты с повышенным содержанием отдельных незаменимых аминокислот
- Качество некоторых пищевых белков относительно белков женского молока
- Аминокислоты
Источник: https://himija-online.ru/organicheskaya-ximiya/aminokisloty/klassifikaciya-aminokislot.html
Аминокислоты, белки. Строение белков. Уровни организации белковой молекулы. Видеоурок. Биология 10 Класс
Среди органических соединений клетки белки являются наиболее важными. Содержание белков в клетке колеблется от 50 % до 80 %.
Белки – это высокомолекулярные органические соединения, которые состоят из углерода, водорода, кислорода, серы и азота. В состав некоторых белков входит фосфор, а также катионы металлов.
Белки являются биополимерами, которые состоят из мономеров аминокислот. Их молекулярная масса варьируется от нескольких тысяч до нескольких миллионов, в зависимости от количества аминокислотных остатков.
В состав белков входит всего 20 типов аминокислот из 170, найденных в живых организмах.
Аминокислоты (см. Рис. 1) – органические соединения, в молекулах которых одновременно присутствует аминогруппа () с основными свойствами и карбоксильная группа () с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение.
Рис. 1. Аминокислота
В зависимости от радикала аминокислоты делят на (см. Рис. 2):
1. кислые (в радикале карбоксильная группа);
2. основные (в радикале аминогруппа);
3. нейтральные (не имеют заряженных радикалов).
Рис. 2. Классификация аминокислот
Аминокислоты соединяются друг с другом посредством пептидной связи. Эта связь образуется путем выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь – пептидной связью.
Рис. 3. Дипептид
Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид (см. Рис. 3).
На одном конце его молекулы находится аминогруппа, а на другом – свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие молекулы.
Если таким образом соединяется много аминокислот, то образуется полипептид (см. Рис. 4).
Рис. 4. Полипептид
Полипептидные цепи бывают очень длинными и могут состоять из различных аминокислот. В состав белковой молекулы может входить как одна полипептидная цепь, так и несколько таких цепей.
Многие животные, включая человека, в отличие от бактерий и растений не могут синтезировать все аминокислоты, которые составляют белковые молекулы. То есть существует ряд незаменимых аминокислот, которые должны поступать с пищей.
К незаменимым аминокислотам относятся: лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин.
Ежегодно в мире производится более двухсот тысяч тонн аминокислот, которые используются в практической деятельности человека. Они применяются в медицине, парфюмерии, косметике, сельском хозяйстве.
- В большей степени производят глутаминовую кислоту и лизин, а также глицин и метионин.
- Назначение аминокислот
- 1. Глутаминовая кислота
Используется в психиатрии (при эпилепсии, для лечения слабоумия и последствий родовых травм), в комплексной терапии язвенной болезни и при гипоксии. Также она улучшает вкус мясных продуктов.
2. Аспарагиновая кислота
Аспарагиновая кислота способствует повышению потребления кислорода сердечной мышцей. В кардиологии применяют панангин – препарат, содержащий аспартат калия и аспартат магния. Панангин применяют для лечения различного рода аритмий, а также ишемической болезни сердца.
3. Метионин
Защищает организм при отравлениях бактериальными эндотоксинами и некоторыми другими ядами, в связи с этим используется для защиты организма от токсикантов окружающей среды. Обладает радиопротекторными свойствами.
4. Глицин
Является медиатором торможения в центральной нервной системе. Используется как успокаивающее средство, применяется при лечении хронического алкоголизма.
5. Лизин
Основная пищевая и кормовая добавка. Используется в качестве антиоксидантов в пищевой промышленности (предотвращает порчу пищевых продуктов).
Отличие между белками и пептидами заключается в количестве аминокислотных остатков. В белках их более 50, а в пептидах менее 50.
В настоящее время выделено несколько сотен различных пептидов, которые выполняют в организме самостоятельную физиологическую роль.
К пептидам относятся:
1. Пептидные антибиотики (грамицидин S).
2. Регуляторные пептиды – вещества, регулирующие многие химические реакции в клетках и тканях организма. К ним относятся: пептидные гормоны (инсулин), окситоцин, стимулирующий сокращение гладкой мускулатуры.
3. Нейропептиды.
В зависимости от строения различают простые и сложные белки.
1. Простые белки состоят только из белковой части.
2. Сложные имеют небелковую часть.
- Если в качестве небелковой части используется углевод, то это гликопротеиды.
- Если в качестве небелковой части используются липиды, то это липопротеиды.
- Если в качестве небелковой части используются нуклеиновые кислоты, то это нуклеопротеиды.
Белки имеют 4 основных структуры: первичную, вторичную, третичную, четвертичную (см. Рис. 5).
Рис. 5. Структура белка
1. Под первичной структурой понимают последовательность аминокислотных остатков в полипептидной цепи. Она уникальна для любого белка и определяет его форму, свойства и функции.
Значительное совпадение первичной структуры характерно для белков, выполняющих сходные функции. Замена всего лишь одной аминокислоты в одной из цепей может изменить функцию молекулы белка. Например, замена глутаминовой кислоты на валин приводит к образованию аномального гемоглобина и к заболеванию, которое называется серповидноклеточная анемия.
2. Вторичная структура – упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей.
3. Третичная структура – укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
4. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникнуть при воздействии температуры, химических веществ, при нагревании и облучении.
Если при денатурации не нарушены первичные структуры, то при восстановлении нормальных условий белок способен воссоздать свою структуру. Этот процесс носит название ренатурация (см. Рис. 6). Следовательно, все особенности строения белка определяются первичной структурой.
Рис. 6. Денатурация и ренатурация
Серповидноклеточная анемия – это наследственная болезнь, при которой эритроциты, участвующие в переносе кислорода, выглядят не в виде диска, а принимают форму серпа (см. Рис. 7). Непосредственной причиной изменения формы является небольшое изменение химической структуры гемоглобина (основного компонента эритроцита).
Рис. 7. Внешний вид нормального и серповидного эритроцита
Симптомы: потеря трудоспособности, постоянная отдышка, учащенное сердцебиение, пониженный иммунитет.
Одним из признаков серповидноклеточной анемии является желтизна кожных покровов.
Существуют различные формы заболевания. В самой тяжелой форме у человека происходит задержка развития, такие люди не доживают до подросткового возраста.
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Vmede.org (Источник).
- Youtube.com (Источник).
- Bio-faq.ru (Источник).
Домашнее задание
- Вопросы 1-6 в конце параграфа 11 (стр. 46) – Каменский А.А., Криксунов Е.А., Пасечник В.В. «Общая биология», 10-11 класс (Источник)
- Какие функциональные группы входят в состав аминокислот?
Источник: https://interneturok.ru/lesson/biology/10-klass/bosnovy-citologii-b/aminokisloty-belki-stroenie-belkov-urovni-organizatsii-belkovoy-molekuly
Строение аминокислот: структурные формулы и классификации
Строение основных аминокислот: 20 «магических», входящих в состав белка. Структура. Классификации. Таблицы с формулами. Название и международные сокращения протеиногенных аминокислот. С вами я, Галина Баева, 20 «магических» аминокислот и красивые таблицы со структурными формулами природных аминокислот.
Природные аминокислоты — это структурные единицы (мономеры) белков. В состав белков входят всего 20 т.н. «магических» аминокислот, которые также называются протеиногенными. Все они имеют сходное строение.
Кроме протеиногенных аминокислот в организме присутствуют и непротеиногенные, которые выполняют различную работу, в основном это промежуточные соединения в биохимическом конвейере, как например, орнитин, сигнальные молекулы, как β-аланин или нейромедиаторы, как ГАМК.
Особенности строения природных аминокислот
Строение аминокислот тесно связано с их функциями. Сходные по химической структуре вещества делают сходную работу. Попробуем разобраться, чтобы потом не путаться в аннотациях к препаратам.
- Все аминокислоты слеплены по одному лекалу.
- Голова – аминный остаток, содержащий азот N.
- Углеродный скелет, состоящий из цепочки атомов углерода (в простейшем случае – один углерод, к которому «спереди» прицеплен аминный остаток, а сзади – карбоновый хвост)
- Хвост – остаток карбоновой кислоты – СООН
Сбоку к углеродному скелету может быть присоединена еще какая-нибудь химическая группировка, которая придает данному веществу особые свойства.
Углеродная цепочка вместе с кислотным хвостом, присоединенная к аминной голове, называется мудреным словом «алифатический радикал».
Номенклатура аминокислот
Углеродная цепочка (скелет) может состоять как из 1 атома углерода, так и из нескольких. В последнем случае имеет значение, к какому атому углерода, начиная счет от карбоксильной группы, присоединится аминная голова.
Это может быть как 1-ый атом углерода, так и 2-ой, 3-ий и далее.
Химики договорились обозначать атомы углерода не цифрами, а буквами греческого алфавита: α — 1-ый атом углерода, начиная с карбоксильного хвоста, β— 2-ой, γ — 3-й, и т.д.
Если аминогруппа присоединяется к углероду в α-положении, такую аминокислоту называют α-аминокислотой, соответственно, если аминогруппа присоединена в β-положении — то это β-аминокислота, если в γ — то γ -аминокислота.
Все 20 природных протеиногенных аминокислот относятся к группе α -аминокислот.
Из β — аминокислот наиболее известен β-аланин, а из γ-аминокислот наиболее известна γ-аминомасляная кислота (ГАМК). Их структурные формулы приведены ниже.
Таблица 1 Строение протеиногенных аминокислот
Таблица 2 Структурные формулы аминокислот
Таблица 3 Модели структурных формул аминокислот
Классификация аминокислот
Существует несколько классификаций аминокислот:
- В зависимости от строения алифатического радикала, аминокислоты подразделяются на следующие группы:
- Просто аминокислоты с алифатическим радикалом, т.е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин
- Аминокислоты с разветвленной боковой цепью, у которых углеродный скелет образует боковые вилки: валин, лейцин, изолейцин. Изолейцин по химическому составу не отличим от лейцина, но его углеродный скелет по-другому загнут, т.е. он является стереоизомером. Иногда его выделяют в отдельную аминокислоту, а иногда – нет. Аминокислоты с разветвленной боковой цепью тоже относятся к группе МоноАминоМоноКарбоновых аминокислот.
- Аминокислоты, у которых в алифатическом радикале имеются разные группировки:
Спиртовая – ОН. Их называют ОксиМоноАминоМоноКарбоновые: серин и треонин
Карбоксильная, т.е. второй кислотный хвост. Это МоноАминоДиКарбоновые аминокислоты: аспарагиновая кислота (аспартат) и глутаминовая кислота (глутамат). Их называют еще Кислые аминокислоты, этакое «масло масляное».
Амидная. Карбоксильный хвост отрастил себе вторую аминную голову: аспарагин и глутамин. Кажется, понятным, что это производные соответственно аспартата и глутамата. Их называют Амиды МоноАминоДиКарбоновых аминокислот
- Аминная. Вторая аминная голова присоединилась к углеродному скелету: лизин
- Гуанидиновая: дополнительные аминные вставки — аргинин
- Лизин и Аргинин относят также к группе ДиАминоМоноКарбоновых аминокислот, ибо у них есть по второй аминной группе. Поскольку эти аминокислоты в нейтральной среде (вода, рН=7), проявляют щелочные (основные) свойства, повышая водородный показатель (рН становится › 7), то их относят к группе Основных аминокислот
- Серосодержащие аминокислоты. Имеют в радикале атом серы S: цистеин, метионин
- Аминокислоты, содержащие ароматический радикал– углеродное колечко или Ароматические аминокислоты фенилаланин, тирозин, триптофан
- Аминокислоты с гетероциклическим радикалом – колечко с атомом азота вместо углерода, поэтому он «гетеро» — «разнообразный»: триптофан и гистидин.
- Нетрудно заметить, что триптофан входит в группу как ароматических аминокислот, так и в группу аминокислот с гетероциклическим радикалом, а все потому, что у него есть как гетороциклический радикал, так и ароматический.
- Иминокислоты – углеродный скелет не вытянут в цепочку, а замкнут в колечко, из которого торчат аминная голова и рядом кислотный хвост: пролин и оксипролин
2. Классификация, в основу которой положена полярность алифатического радикала.
- Неполярные (гидрофобные) аминокислоты. Они имеют неполярные связи между атомами C-C, C-H. Это глицин, аланин, валин, лейцин, изолейцин, пролин, триптофан — 8 аминокислот
- Полярные незаряженные (гидрофильные) аминокислоты. Они имеют полярные связи между атомами С-О, C-N, O-H, S-H. Это серин, аспарагин, глутамин, треонин, метионин — 5 аминокислот
- Полярные отрицательно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН = 7) заряжены отрицательно, т.е. они выступают как отрицательно-заряженный ион (анион). Это аспарагиновая и глутаминовая кислоты, тирозин, цистеин — 4 аминокислоты
- Полярные положительно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН=7) заряжены положительно, т.е. они выступают как положительно-заряженный ион (катион). Это лизин, аргинин, гистидин — 3 аминокислоты.
Чем больше в белке аминокислот, обладающих полярностью, тем выше способность белка к химическим реакциям, т.е. его реактогенность. С реактогенностью белка непосредственно связаны его функции.
Белки соединительной ткани, например кератин, входящий в состав волос и ногтей, имеет мало полярных аминокислот.
Напротив, ферменты — белки-катализаторы биохимических реакций, обладают аминокислотным составом с множеством полярных групп.
3. Классификация по отношению к водородному показателю (рН)
- Аминокислоты, обладающие нейтральными свойствами с рН 5,97 – 6,02. Это глицин, аланин, серин, валин, лейцин, изолейцин,треонин, цистин, метионин — 9 аминокислот. Они имеют одну аминную голову и один карбоксильный хвост
- Аминокислоты, обладающие слабокислыми свойствами рН 3,0 – 5,7. Это аспарагиновая и глутаминовая кислоты. Они имеют одну аминную голову, но два карбоксильных хвоста, поэтому их называют «кислотами».
- Аминокислоты, обладающие щелочными свойствами с рН 9,7 – 10,7. У них две аминные головы и один карбоксильный хвост. Это лизин, аргинин, гистидин.
4. Классификация по способности к синтезу в организме человека и животных.
- Заменимые аминокислоты: глицин, серин, аланин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин
- Условно-заменимые аминокислоты: аргинин, гистидин, тирозин, цистеин
- Незаменимые аминокислоты: валин, лейцин, изолейцин, треонин, лизин, триптофан, фенилаланин, метионин
Подробнее о них рассказывается здесь: Аминокислоты заменимые и незаменимые: где взять.
5. Классификация аминокислот по путям биосинтеза.
В живых организмах аминокислоты могут производится (синтезироваться) из других соединений. Путь биосинтеза — это последовательность химических реакций, которые обусловлены наследственной (генетической) матрицей. Он записан в генетическом коде и обусловлен наличием ферментов, запускающих данные реакции.
Биосинтез идет не хаотично, а количество исходных и промежуточных соединений ограничено. Так из всего многообразия природных аминокислот для синтеза белка используются только 20.
Соответственно, исходные и промежуточные соединения на путях биосинтеза отдельных аминокислот образуют кластеры или семейства, где соединения могут преобразовываться друг в друга.
- Семейство аспартата: аспарагиновая кислота (аспартат), аспарагин, изолейцин, лизин, треонин, метионин
- Семейство глутамата: глутаминовая кислота (глутамат), глутамин, пролин, аргинин
- Семейство пирувата: аланин, валин, лейцин
- Семейство серина: серин, глицин, цистеин
- Семейство пентоз: гистидин, триптофан, фенилаланин, тирозин
- Семейство шикимата: триптофан, фенилаланин, тирозин
Надо сказать, что данные пути метаболизма реализуются в биологических системах, но не все они имеются в организме человека. Так высшие животные и человек не способны синтезировать ароматическое кольцо, поэтому путь шикимата — это не для нас. Аналогично с другими путями синтеза незаменимых аминокислот. Для наглядности незаменимые аминокислоты выделены жирным шрифтом.
6. Классификация аминокислот по путям катаболизма
Катаболизм — процесс распада, противоположен анаболизму или процессу синтеза. В организме катаболизм также обусловлен генетической программой и набором ферментов.
Конечным итогом деградации аминокислот является аммиак, вода и углекислый газ, а также выделяется энергия в виде тепла или связанная в молекулах АТФ.
В зависимости от промежуточных соединений, дающих энергию, аминокислоты подразделяются на следующие группы:
- Глюкогенные: дающие метаболиты (промежуточные соединения), из которых может быть синтезирована глюкоза: глицин, аланин, серин, треонин, валин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, аргинин, гистидин, цистин, метионин
- Кетогенные: распадающиеся до ацетоацетилКоА и ацетилКоА, из которых могут быть синтезированы кетонные тела: лизин, лейцин
- Промежуточные: при распаде этих аминокислот образуются метаболиты обоих типов: изолейцин, триптофан, фенилаланин, тирозин
Подробнее о глюкогенных и кетогенных аминокислотах можно прочитать здесь: Гликогенные аминокислоты
Правые и левые аминокислоты
В зависимости от прикрепления аминогруппы по отношению к карбоксильному хвосту в углеродной цепочке, аминокислоты могут быть «правыми» или «левыми», иначе говоря, их относят к D- или L- изомерам. Такие формы называют оптически активными, они не отличаются по химическому составу, но в пространстве относятся друг другу, как левая и правая рука.
В белковые молекулах присутствуют только L (левые) -изомеры аминокислот, правые (D) -изомеры могут обладать особыми свойствами и выступать как медиаторы, т.е. сигнальные молекулы, но чаще они образуют балласт. В обычных продуктах питания D-аминокислот практически нет.
Они образуются при химическом синтезе и могут встречаться в искусственных протеинах, используемых в спортивном питании или в качестве биологически-активных добавок к пище. D-аминокислоты с трудом расщепляются ферментами, ибо они не физиологичны.
В печени и почках содержится особый фермент — оксидаза D-аминокислот, предполагают, что она превращает нефизиологичные правые аминокислоты в физиологичные левые. Количество ее невелико, т.к. обычно в пище содержится очень мало D-аминокислот.
При химическом синтезе образуется равное количество D- и L- изомеров, но в синтезе белка участвуют аминокислоты только L – ряда. Это следует учитывать лицам, принимающим препараты аминокислот: L-аминокислоты будут существенно дороже из-за необходимости их выделения из смеси, но эффект от их применения будет существенно выше
Читайте далее о том, что делает в организме каждая аминокислота. Поверьте, им есть, чем заняться. С вами была Галина Батуро. Делитесь информацией в соц.сетях, оставляйте комментарии.
Источник: https://zaryad-zhizni.ru/stroenie-osnovnyih-aminokislot/
§ 6. Аминокислоты как структурные элементы белков
- Глава III. БЕЛКИ
- § 6. АМИНОКИСЛОТЫ КАК СТРУКТУРНЫЕ ЭЛЕМЕНТЫ БЕЛКОВ
- Природные аминокислоты
Аминокислоты в живых организмах встречаются преимущественно в составе белков.
Белки построены в основном двадцатью стандартными аминокислотами. Они являются a-аминокислотами и отличаются друг от друга строением боковых групп (радикалов), обозначаемых буквой R:
Разнообразие боковых радикалов аминокислот играет ключевую роль при формировании пространственной структуры белков, при функционировании активного центра ферментов.
Структура стандартных аминокислот приведена в конце параграфа в табл.3. Природные аминокислоты имеют тривиальные названия, оперировать которыми при записях структуры белков неудобно. Поэтому для них введены трехбуквенные и однобуквенные обозначения, которые также представлены в табл.3.
Пространственная изомерия
У всех аминокислот, за исключением глицина, a-углеродный атом является хиральным, т.е. для них характерна оптическая изомерия. В табл. 3 хиральный атом углерода обозначен звездочкой. Например, для аланина проекции Фишера обоих изомеров выглядят следующим образом:
Для их обозначения, как и для углеводов, используется D, L-номенклатура. В состав белков входят только L-аминокислоты.
L- и D-изомеры могут взаимно превращаться друг в друга. Этот процесс называется рацемизацией.
Интересно знать! В белке зубов – дентине – L-аспарагиновая кислота самопроизвольно рацемизуется при температуре человеческого тела со скорость 0,10 % в год.
В период формирования зубов в дентине содержится только L-аспарагиновая кислота, у взрослого же человека в результате рацемизации образуется D-аспарагиновая кислота. Чем старше человек, тем выше содержание D-изомера.
Определив соотношение D- и L-изомеров, можно достаточно точно установить возраст. Так были изобличены жители горных селений Эквадора, приписывавшие себе слишком большой возраст.
Химические свойства
Аминокислоты содержат амино- и карбоксильную группы. В силу этого они проявляют амфотерные свойства, то есть свойства и кислот и оснований.
При растворении аминокислоты в воде, например, глицина, его карбоксильная группа диссоциирует с образованием иона водорода. Далее ион водорода присоединяется за счет неподеленной пары электронов у атома азота к аминогруппе. Образуется ион, в котором одновременно присутствуют положительный и отрицательный заряды, так называемый цвиттер-ион:
Такая форма аминокислоты является преобладающей в нейтральном растворе. В кислой среде аминокислота, присоединяя ион водорода, образует катион:
В щелочной среде образуется анион:
Таким образом, в зависимости от рН среды аминокислота может быть положительно заряженной, отрицательно заряженной и электронейтральной (при равенстве положительных и отрицательных зарядов).
Значение рН раствора, при котором суммарный заряд аминокислоты равен нулю, называется изоэлектрической точкой данной аминокислоты. Для многих аминокислот изоэлектрическая точка лежит вблизи рН 6.
Например, изоэлектрические точки глицина и аланина имеют значения 5,97 и 6,02 соответственно.
Две аминокислоты могут реагировать друг с другом, в результате чего отщепляется молекула воды и образуется продукт, который называется дипептидом:
Связь, соединяющая две аминокислоты, носит название пептидной связи. Если пользоваться буквенными обозначениями аминокислот, образование дипептида можно схематически представить следующим образом:
Аналогично образуются трипептиды, тетрапептиды и т.д.:
- H2N – лиз – ала – гли – СООН – трипептид
- H2N – трп – гис – ала – ала – СООН – тетрапептид
- H2N – тир – лиз – гли – ала – лей – гли – трп – СООН – гептапептид
- Пептиды, состоящие из небольшого числа аминокислотных остатков, имеют общее название олигопептиды.
Интересно знать! Многие олигопептиды обладают высокой биологической активностью. К ним относится ряд гормонов, например, окситоцин (нанопептид) стимулирует сокращение матки, брадикинин (нанопептид) подавляет воспалительные процессы в тканях.
Антибиотик грамицидин С (циклический декапептид) нарушает регуляцию ионной проницаемости в мембранах бактерий и тем самым убивает их. Грибные яды аманитины (октапептиды), блокируя синтез белка, способны вызвать сильное отравление у человека. Широко известен аспартам — метиловый эфир аспартилфенилаланина.
Аспартам имеет сладкий вкус и используется для придания сладкого вкуса различным продуктам, напиткам.
- Классификация аминокислот
- Существует несколько подходов к классификации аминокислот, но наиболее предпочтительной является классификация, основанная на строении их радикалов. Выделяют четыре класса аминокислот, содержащих радикалы следующих типов; 1) неполярные (или гидрофобные); 2) полярные незаряженные; 3) отрицательно заряженные и 4) положительно заряженные:
- К неполярным (гидрофобным) относятся аминокислоты с неполярными алифатическими (аланин, валин, лейцин, изолейцин) или ароматическими (фенилаланин и триптофан) R-группами и одна серусодержащая аминокислота – метионин.
Полярные незаряженные аминокислоты в сравнении с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие полярную НО-группу (серин, треонин и тирозин), HS-группу (цистеин), амидную группу (глутамин, аспарагин) и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам. Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин, в ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
Десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в человеческом организме. Остальные должны содержаться в нашей пище.
К ним относятся аргинин, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин и гистидин. Эти аминокислоты называются незаменимыми.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Интересно знать! Исключительно важную роль играет сбалансированность питания человека по аминокислотам. При недостатке незаменимых аминокислот в пище организм саморазрушается.
При этом страдает в первую очередь головной мозг, что приводит к различным заболеваниям центральной нервной системы, психическим расстройствам. Особенно уязвим молодой растущий организм.
Так, например, при нарушении синтеза тирозина из фенилаланина у детей развивается тяжелое заболевание финилпировиноградная олигофрения, вызывающее тяжелую умственную отсталость или гибель ребенка.
Таблица 3
Стандартные аминокислоты
| Аминокислота (тривиальное название) | Условные обозначения | Структурная формула | |
| Русское | Латинское | ||
| трехбук- венное | однобук-венное | ||
| НЕПОЛЯРНЫЕ (ГИДРОФОБНЫЕ) | |||
| Аланин | Ала | Ala | A |
| Валин | Вал | Val | V |
| Лейцин | Лей | Leu | L |
| Изолейцин | Иле | Ile | I |
| Пролин | Про | Pro | P |
| Фенилаланин | Фен | Phe | F |
| Триптофан | Трп | Trp | W |
| Метионин | Мет | Met | M |
| ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ | |||
| Серин | Сер | Ser | S |
| Треонин | Тре | Thr | T |
| Аспарагин | Асн | Asn | N |
| Глутамин | Глн | Gln | Q |
| Цистеин | Цис | Cys | C |
| Тирозин | Тир | Tyr | Y |
| Глицин | Гли | Gly | G |
| ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЕ | |||
| Аспарагиновая кислота | Асп | Asp | D |
| Глутаминовая кислота | Глу | Glu | E |
| ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫЕ | |||
| Лизин | Лиз | Lys | K |
| Аргинин | Арг | Arg | R |
| Гистидин | Гис | His | H |
Примечание: * хиральный атом углерода.
Источник: https://ebooks.grsu.by/osnovi_biohimii/6-aminokisloty-kak-strukturnye-elementy-belkov.htm